Il existe, à l'heure actuelle, de nombreux anticorps monoclonaux thérapeutiques couramment utilisés en immunothérapie anticancéreuse. Dans les années à venir, un nombre considérable de thérapies anticancéreuses ciblées, reposant sur l'utilisation de tels anticorps, devrait être disponible. Afin de choisir la meilleure thérapie, il est crucial de procéder à une analyse moléculaire des cellules cancéreuses et de quantifier un maximum de biomarqueurs protéiques, signatures de la lésion tumorale. L'utilisation itérative d'anticorps fluorescents pour quantifier ces biomarqueurs in vitro est assez largement utilisée (immunofluorescence cyclique), mais reste limitée par le nombre de fluorophores détectables.
Dans ce manuscrit, les auteurs décrivent le développement d'une stratégie inédite d'analyse multiplexée de cellules et tissus tumoraux in vitro et in vivo en appliquant leur chimie de clivage bioorthogonale unique sur des anticorps marqués avec du TMPP, une étiquette de spectrométrie de masse (SM-tag), à partir de laquelle il est théoriquement possible de générer 61 isotopologues. Les chercheurs ont sélectionné 4 isotopologues du TMPP qu'ils ont liés à quatre anticorps thérapeutiques approuvés par la FDA par le biais de liens clivables sydnonimine, développés au laboratoire (SPICC).
Après réaction bioorthogonale « click-and-release », dans laquelle le SM-tag est libéré au profit de l'accrochage d'un composé fluorescent, il a été possible de localiser l'ensemble des récepteurs antigéniques tumoraux (marquage fluorescent), ainsi que d'identifier et de quantifier ces 4 récepteurs par analyse en spectrométrie de masse des SM-tags clivés et libérés. Comparée à l'immunofluorescence cyclique, cette stratégie ne fournit pas d'informations spatiales sur les différents récepteurs mais offre i) un plus grand nombre de biomarqueurs cancéreux détectés, ii) une (semi-) quantification des niveaux d'expression de ces biomarqueurs et iii) la possibilité d'utiliser la technologie in vivo.
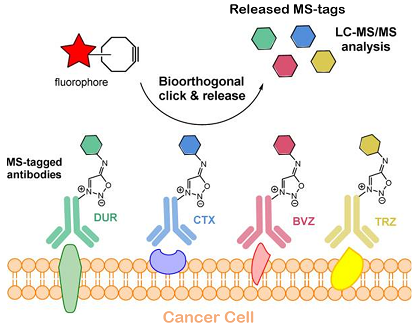
Profilage immunologique du cancer : la combinaison de la chimie bioorthogonale et de l'analyse LC-MS/MS utilisée avec succès pour l'imagerie et la quantification de 4 récepteurs cancéreux surexprimés dans des cellules, des tissus et in vivo. Ribéraud et al., Chem Sci 2024
L'originalité de l'approche décrite dans la présente étude repose sur la combinaison inédite de deux technologies : la conception de liaisons clivables par chimie-click sur un cocktail d'anticorps anticancéreux et la détection multiplexée en spectrométrie de masse de plusieurs tags-MS spécifiques de chaque anticorps. Une approche prometteuse qui a permis la détection de quatre marqueurs tumoraux sur des cellules en culture, des biopsies et chez un modèle animal porteur de la tumeur.
-
Immunoprofilage tumoral : détection de la présence de certains antigènes surexprimés par les cellules cancéreuses au moyen d'anticorps.
- Le
TMPP (tris(2,4,6,-trimethoxyphenyl)-phosphonium) est un tag-SM très adapté aux études protéomiques. Il possède 9 groupes méthoxy, 6 hydrogènes et 27 atomes de carbone, soit autant de possibilités pour le marquage au deutérium ou au carbone 13. Au total, 60 atomes peuvent ainsi être marqués isotopiquement, permettant de générer théoriquement 61 isotopologues.
-
SPICC : En 2017, les chercheurs du SCBM découvrent que les iminosydnones (réactifs mésoioniques) constituent des réactifs de choix pour des réactions click-and-release. Greffées à une protéine, elles réagissent rapidement avec des alcynes cycliques présentes dans des milieux biologiques pour former un premier produit issu de la ligation des 2 partenaires réactionnels (protéine + alcyne cyclique), puis un deuxième correspondant au relargage de l'iminosydnone de la protéine (
strain-promoted iminosydnones-cycloalkyne cycloaddition, SPICC).
Voir
actu Joliot
Voir aussi actu CEA : Soigner avec les anticorps monoclonaux.