Des mutations dans les gènes codant les sous-unités du complexe BAF (BRG1/BRM-associated factor, appelé aussi complexe SWI/SNF) sont associées à 20% des cancers humains, faisant de ce complexe le deuxième facteur le plus fréquement muté après le suppresseur de tumeurs p53 dans ces pathologies. Les mutations de différentes sous-unités du complexe BAF sont associées à différents types de cancers, dans différents tissus. Le complexe BAF joue un rôle clé dans la régulation de l'accès à notre génome, mais les mécanismes moléculaires de cette régulation sont mal connus.
Le génome humain existe dans les cellules sous la forme de chromatine, composée d'un chapelet de nucléosomes qui condensent et protègent le matériel génétique. Chaque nucléosome est un octamère de huit protéines histones autour duquel s'enroule un segment d'ADN. La présence des nucléosomes sur l'ensemble du génome est une barrière physique pour les machineries moléculaires qui régulent l'expression des gènes. Le complexe BAF est connu pour son rôle dans le contrôle de l'ouverture de la chromatine au niveau des éléments régulateurs de l'expression des gènes. Jusqu'à présent, on pensait que le rôle du complexe BAF consistait à dissocier quelques nucléosomes pour permettre aux machineries moléculaires d'accéder à l'ADN.
Grâce à une méthode originale et robuste qui leur permet de différencier des segments d'ADN « libres » de segments enroulés sous forme de nucléosomes ou de fragments de nucléosomes, des chercheurs sous la direction de
Matthieu Gérard (Institut Frédéric-Joliot / I2BC), ont étudié le rôle du complexe BAF. Ils montrent qu'il confère l'accès à une séquence d'ADN en la faisant passer par plusieurs états possibles :
- De l'état initial « fermé », sous forme de nucléosome, c'est-à-dire 146 paires de bases enroulées autour d'un octamère d'histones ;
- En passant par plusieurs états intermédiares « ouverts » dans lesquels le nucléosome subit des modifications : le complexe BAF repère des nucléosomes fragilisés qu'il va d'abord diviser en particules plus petites, appelées « subnucléosomes », comportant 50 à 80 paires de bases enroulées autour d'un tétramère d'histones ;
- A l'état final « ouvert », correspondant à la séquence d'ADN débarrassée de tous les histones ;
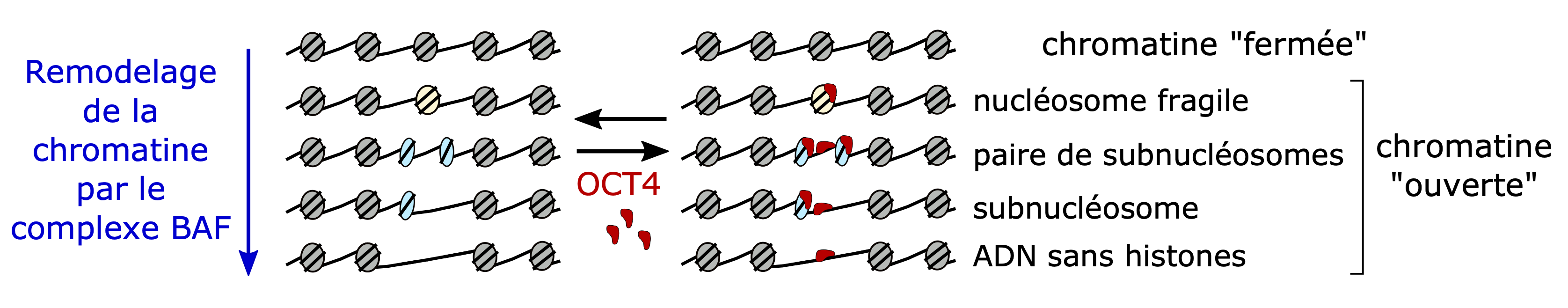
Modèle d'action de cBAF. © M. Gérard / CEA
Cette étude a révélé de manière inattendue que les particules de type « subnucléosomes » sont des substrats de liaison du facteur de transcription OCT4, très connu pour son rôle dans le maitien de la pluripotence des cellules souches embryonnaires, quand bien même les motifs classiques de liaison à l'ADN d'OCT4 ne sont pas présents, augmentant ainsi considérablement la présence d'OCT4 sur l'ADN. Ce mécanisme montre que OCT4 peut exercer certaines de ses fonctions en dehors de ses liaisons directes à l'ADN.
Contact Institut des sciences du vivant Frédéric-Joliot