REMODELAGE MEMBRANAIRE ET RÉPLICATION VIRALE
Les virus ne peuvent pas se répliquer de manière autonome et, une fois entrés dans la cellule hôte, chaque type de virus doit élaborer sa propre stratégie de réplication pour survivre et se propager. Le remodelage membranaire constitue un aspect essentiel de la stratégie de propagation de nombreux virus pathogènes pour l'homme. On sait que certains virus à ARN utilisent ce processus en mobilisant et modifiant les membranes de la cellule hôte pour élaborer des structures intracellulaires spécialisées qui servent d'usines de réplication au génome viral. C'est le cas des coronavirus en général et du SARS-CoV-2 en particulier pour lequel le processus de remodelage membranaire conduit à la formation de compartiments appelés vésicules à double membrane (DMVs). L'ARN viral synthétisé au sein de ces compartiments membranaires doit ensuite être exporté vers le cytoplasme de la cellule hôte pour être traduit en protéines virales ou incorporé dans de nouvelles particules virales. Cet export se fait au travers de pores moléculaires en forme de couronne récemment découverts dans les membranes des DMVs.
NSP3, UNE PROTÉINE VIRALE IMPLIQUÉE DANS LE REMODELAGE MEMBRANAIRE
Parmi les protéines du SARS-CoV-2 impliquées dans la biogénèse des DMVs, la protéine non structurale 3 (nsp3) joue un rôle prépondérant, et serait le composant majoritaire de ces pores, avec 6 molécules présentes par pore. Les extrémités N-terminales de nsp3 seraient orientées vers le cytoplasme (pointes de la couronne), tandis que ses parties C-terminales pointeraient vers l'intérieur des DMVs (voir figure). Nsp3 apparaît donc comme une cible thérapeutique de choix mais la taille et la complexité de cette longue protéine de 1945 acides aminés rendent son étude structurale difficile.
L'objectif du présent travail a été de considérer la région C-terminale de nsp3, qui contient les segments transmembranaires, afin de comprendre comment elle est organisée et comment elle contribue à l'agencement des pores moléculaires. Afin d'obtenir des quantités suffisantes de matériel, cette partie de la protéine (notée nsp3C) a été exprimée dans un système acellulaire avant d'être reconstituée dans des nano-disques de lipides pour permettre son observation en microscopie électronique. Les images ont révélé des objets présentant une organisation oligomérique en anneaux avec un pore central. En combinant ces données expérimentales aux prédictions structurales obtenues grâce au logiciel d'intelligence artificielle AlphaFold, les auteurs ont mis en évidence les capacités d'auto-association de la protéine et ont pu la positionner dans un modèle de pores moléculaires (figure).
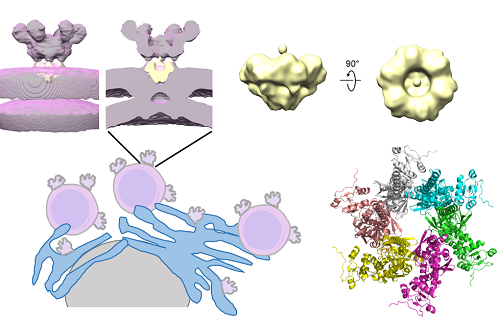
Schéma illustrant la présence de vésicules à double membrane (violet) associées aux membranes du réticulum endoplasmique (bleu). Ces vésicules présentent à leur surface des pores moléculaires en forme de couronne (gris). Deux perspectives d'une reconstruction 3D de l'enveloppe de nsp3C reconstituée en nanodisques lipidiques (jaune) sont figurées : une vue latérale et une vue de face. En haut, à gauche : positionnement de l'enveloppe sur le pore moléculaire. En bas, à droite : modèle de nsp3C obtenu avec AlphaFold. Babot et al., Med Sci (Paris), 2024
L'approche expérimentale et biocomputationnelle utilisée dans ce travail fournit des indices sans précédent sur l'organisation structurale de nsp3, composant principal des pores moléculaires présents à la surface des vésicules à double membrane et nécessaires à l'exportation de l'ARN viral nouvellement synthétisé dans le cytoplasme des cellules hôtes. En révélant l'organisation oligomérique d'un acteur clé de la biogenèse des DMVs du SARS-CoV-2, ces résultats constituent une base solide pour la conception de futures stratégies antivirales.
Contact : virginie.gervais@i2bc.paris-saclay.fr ou marion.babot@universite-paris-saclay.fr