Chaque année en France, le virus de la grippe est responsable d'épidémies impactant entre 2 et 6 millions de personnes. De plus, ces virus influenza très proches du virus affectant l'homme provoquent des épizooties (maladie frappant une espèce animale), faisant craindre en permanence l'émergence de nouvelles souches par franchissement de la barrière entre espèces. Ainsi, dans de nombreux pays et notamment aux États-Unis, les services sanitaires surveillent actuellement la propagation du virus de la grippe aviaire parmi les élevages bovins.
En parallèle des vaccins, les scientifiques développent des stratégies visant à déstabiliser le génome viral de la grippe. Celui-ci est constitué de huit molécules d'ARN simple brin et chacune d'elles est enveloppée de multiples copies de la nucléoprotéine virale. Ces molécules forment des complexes ribonucléoprotéiques, structurés en double hélice antiparallèle, flexibles et dynamiques qui sont responsables de la prolifération virale.
Comprendre la stabilité des complexes ribonucléoprotéiques
En 2023, des chercheurs de l'Irig étaient parvenus à produire – par auto-assemblage in vitro de nucléoprotéines et de sondes ARN – des analogues des complexes ribonucléoprotéiques. Ce procédé leur avait permis de proposer un premier modèle d'encapsulation du génome du virus de la grippe à l'échelle nanométrique, obtenu par cryo-microscopie électronique. Mais ils n'avaient pas pu déterminer le sens des doubles hélices dans ce modèle, ni décrire précisément les interactions entre l'ARN et les molécules de nucléoprotéine pour comprendre la stabilité de la structure.
Dans une nouvelle étude, ils ont réitéré l'expérience en optimisant la séquence de la nucléoprotéine et, en augmentant la taille des sondes ARN, ils sont parvenus à des reconstructions 3D à l'échelle atomique des complexes ribonucléoprotéiques.
Celles-ci leur ont permis, pour la première fois, de visualiser précisément les molécules d'ARN sous le manteau protecteur des nucléoprotéines et de comprendre comment les deux hélices de protéine interagissent entre elles, au sein de cette architecture complexe et flexible.
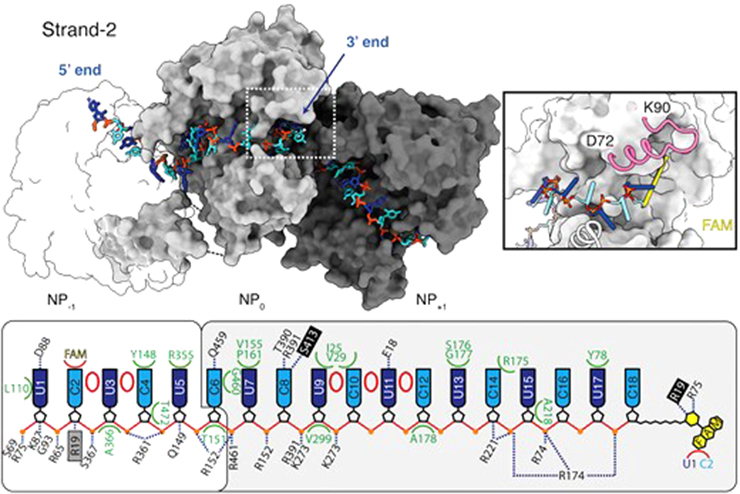 Détail des interactions entre les deux hélices de protéine. © CEA-Irig
Détail des interactions entre les deux hélices de protéine. © CEA-Irig
Ces travaux ouvrent la voie à la conception de molécules ciblant spécifiquement les zones d'interaction protéine-ARN, pour restreindre la formation des complexes ribonucléoprotéiques et empêcher la prolifération du virus de la grippe.