Les protéines contenant des centres fer-soufre (Fe-S) interviennent dans de nombreux processus cellulaires, tels que la réplication et la réparation de l’ADN, la respiration ou la photosynthèse. Leur importance réside dans leur polyvalence fonctionnelle, incluant le transfert d'électrons, la catalyse redox et non redox, la régulation de l’expression des gènes, et l’apport d’atomes de soufre. Ces clusters Fe-S ne se forment pas spontanément in vivo mais nécessitent pour leur assemblage des machineries multiprotéiques complexes, appelées « usines à Fe-S ».
Depuis longtemps, les chercheurs du CEA-Irig se concentrent sur la compréhension de ces machineries. Ces usines préforment les clusters Fe-S avant de les transférer vers les protéines cibles de la cellule, telles que les complexes respiratoires. La nature exacte et les ligands des centres Fe-S au sein de ces usines restent encore énigmatiques, malgré les progrès récents en biophysique et en génétique.
Dans cet article, les chercheurs [Collaboration] ont étudié l’usine à centres Fe-S SufBC2D chez les bactéries. A partir d’un système purifié à l’état natif, ils ont caractérisé cette usine contenant des clusters Fe-S naturels. Grâce à des techniques de caractérisations biophysiques telles que la spectroscopie d’absorption X, la spectroscopie Mössbauer, la spectroscopie de résonance paramagnétique électronique et la spectroscopie d’absorption UV-visible, ils ont découvert que SufBC2D contient principalement un cluster de type [2Fe-2S], et une espèce non identifiée, possiblement un cluster de type [3Fe-5S].
En analysant des variants de l’usine, les chercheurs ont identifié plusieurs acides aminés impliqués dans la coordination du cluster [2Fe-2S], impliquant une coordination à l’interface des protéines SufB et SufD. Cette étude apporte des informations nouvelles sur l'organisation moléculaire des clusters Fe-S dans l’usine SufBC2D et soulève des questions sur la nature de la deuxième espèce fer-soufre observée, un sujet à explorer davantage dans le cadre de la biosynthèse des clusters Fe-S et de façon plus large dans celui de la chimie bioinorganique.
Ces travaux permettent de mieux comprendre les mécanismes de formation des clusters Fe-S in vivo dans la perspective d’ouvrir de nouvelles voies pour des applications biotechnologiques et médicales.
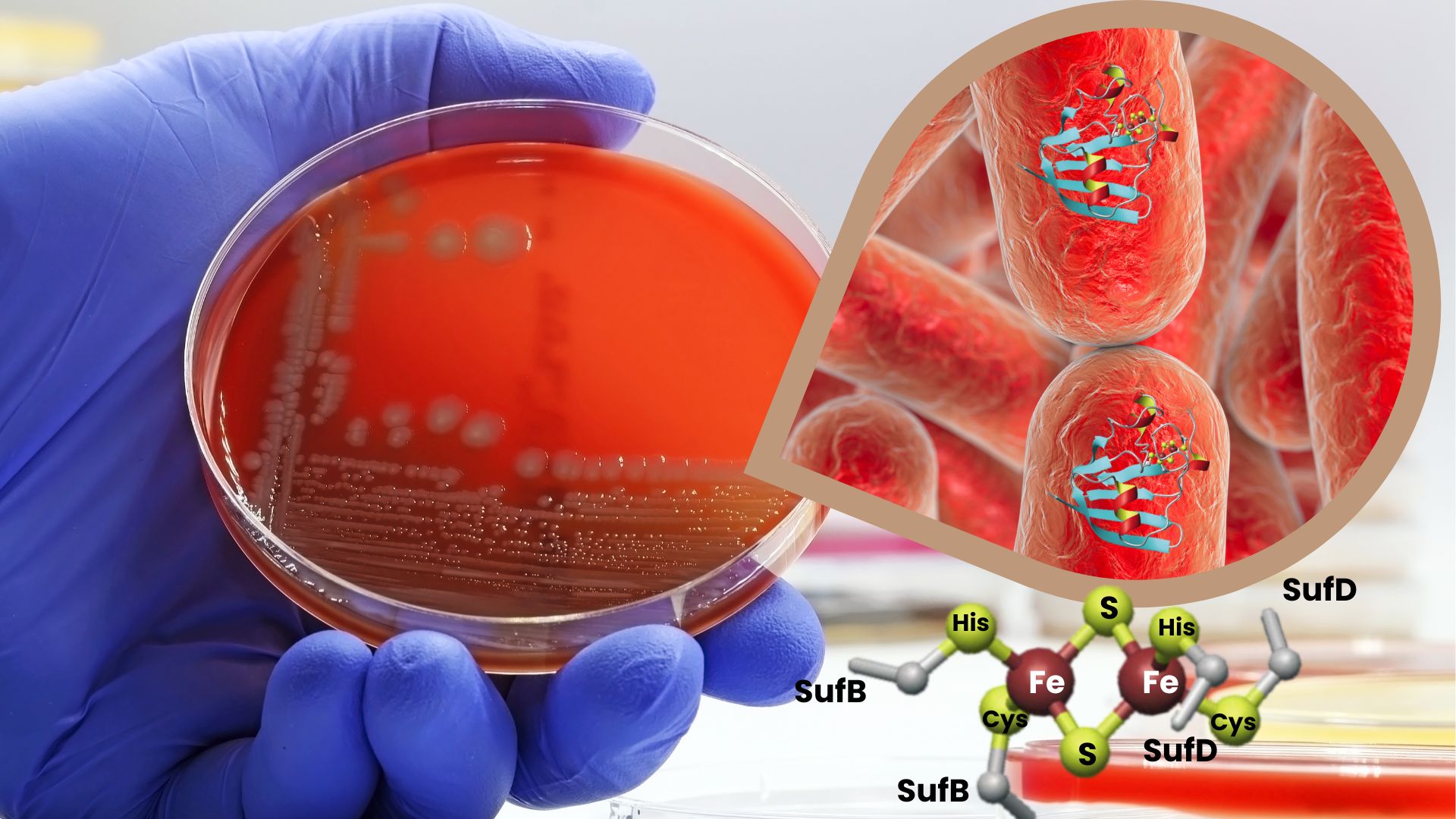
Figure : Etude de l’usine SufBC2D dans la bactérie E. coli (© CEA)
Collaboration
- LCBM / BioCat, PMB, ComX
- Irig/SYMMES, CAMPE
- Institut Pasteur/Adaptation au stress et Metabolisme
- Laboratoire Chimie Biologie, Marseille
Financements
- Projet ANR FeStreS (2012-2016)
- Projet ANR MASTIC (2023-2027)