Les métaux sont essentiels au fonctionnement cellulaire. Pour leur faire franchir la membrane des cellules, des protéines membranaires spécialisées vont se charger soit de leur import, en cas de carence par exemple, soit de leur export lorsqu’ils sont à des concentrations potentiellement toxiques pour la cellule.
Présentes dans tous les organismes vivants, les ATPases-P
1B constituent une des familles de protéines membranaires spécialisées dans le transport des métaux, qu’ils soient toxiques tels que le cadmium et le plomb ou essentiels à faible dose et toxiques à forte dose, tels que le zinc et le cuivre. Ces ATPases-P
1B partagent le même mécanisme enzymatique et en partie la même organisation structurale que d’autres ATPases-P étudiées depuis plusieurs décennies telles que les ATPases transportant le calcium ou les échangeurs sodium/potassium.
En 2011, l’équipe dirigée par Olivier Neyrolles de l’Institut de Pharmacologie et de Biologie Structurale de Toulouse a mis en évidence un rôle jusqu’alors inconnu des ATPases- P
1B. En premier lieu, cette équipe a montré que lors d’une infection par
Mycobacterium tuberculosis, la bactérie pathogène capturée et stockée dans les phagosomes du macrophage était soumise à des concentrations toxiques de zinc (
Figure A). Elle a aussi démontré que pour survivre à cet empoisonnement métallique, la bactérie surproduisait une ATPase-P
1B, CtpC, dont le rôle est d’exporter le zinc en excès dans son cytoplasme.
 Figure A
Figure A :
M. tuberculosis à l’intérieur du phagosome d’un macrophage où s’est accumulé le zinc. Credit CEA
Dans la présente étude, des chercheurs de l’Irig [collaboration] experts des ATPases-P
1B montrent que CtpC ne peut fonctionner sans la présence d’une petite protéine membranaire de fonction jusqu’alors inconnue :
PacL1. Cette protéine se colocalise avec CtpC au niveau de microdomaines dans la membrane bactérienne (
Figure B) et possède un motif de liaison du zinc à son extrémité C-terminale. Sans PacL1, CtpC n’est plus localisée à la membrane et
M. tuberculosis devient très sensible au zinc. Dans cette étude, les chercheurs ont identifié dans
M. tuberculosis deux autres couples ATPase-P
1B/PacL impliqués dans le transport de métaux : CtpG/PacL2 et CtpV/PacL3. Par ailleurs, d’autres couples ATPase-P
1B/PacL sont aussi retrouvés chez différents types de bactéries.
 Figure B
Figure B : Image par EPIfluorescence de la colocalisation de PacL1
mTurquoise et CtpC
mVenus dans
M. tuberculosis. Credit CEA
Ces travaux suggèrent que la résistance aux métaux chez certaines bactéries pourrait utiliser des plateformes membranaires associant des ATPases-P
1B et de petites chaperones de type PacL, un nouveau concept dans la métallobiologie des procaryotes (
Figure C). Ils ouvrent aussi de nouvelles perspectives pour combattre des bactéries pathogènes en ciblant leurs mécanismes de résistance aux stress métalliques.
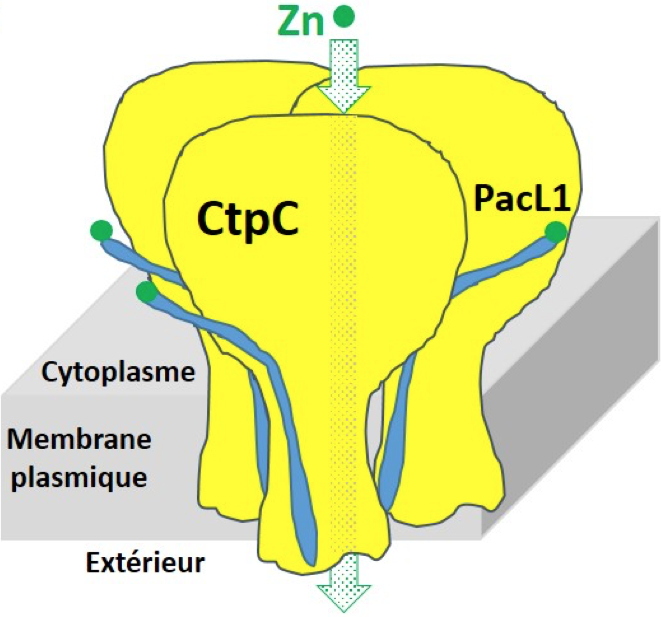 Figure C
Figure C : Représentation schématique d’une plateforme membranaire d’efflux de zinc par CtpC/PacL1. Credit CEA
PacL1 (P-ATPase-associated chaperone-Like protein 1) est une protéine membranaire nécessaire à l’adressage et à la fonction de transport de CtpC d’où l’appellation « chaperonne ».